Sâmia Bomfim solicitou consulta pública para discutir fornecimento de medicamentos para AME no SUS
Demanda de familiares, pacientes e organizações civis motivou apresentação de requerimento pela parlamentar do PSOL. Eles pedem a inclusão e fornecimento de medicamentos destinados ao tratamento de Atrofia Muscular Espinhal 5q.
5 out 2021, 15:03 Tempo de leitura: 3 minutos, 39 segundos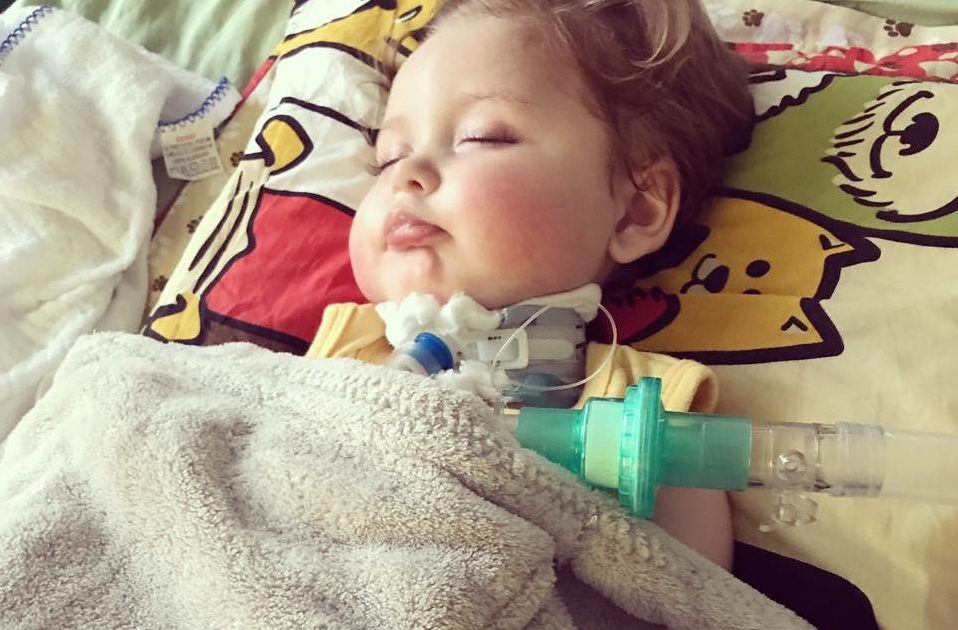
No início de setembro de 2021, a deputada federal Sâmia Bomfim apresentou requerimento à Comissão Nacional de Incorporação de Tecnologias (Conitec) no Sistema Único de Saúde solicitando realização de consulta pública a respeito da incorporação dos seguintes medicamentos de tratamento da Atrofia Muscular Espinhal 5q (AME) no âmbito do SUS.
O pedido para realização da consulta pública foi uma demanda de familiares, pacientes e organizações civis que lidam com a Atrofia Muscular Espinhal e baseado na reportagem do G1 Portadores da “AME” sofrem com falta de remédios que têm um custo absurdamente alto, muitas vezes sendo quase impossível a compra pelos pacientes.
Conforme apresentado pela parlamentar, no requerimento, a inclusão e fornecimento desses medicamentos pelo SUS estaria alinhado ao interesse público, considerando que tal incorporação e distribuição teria o potencial de reduzir a complicação da saúde das pessoas com AME 5q, bem como levaria à redução de ações judiciais para obtenção de tais medicamentos pelos pacientes.
Conitec informou que a consulta pública para manifestação da sociedade acerca da atualização do Protocolo Clínico e Diretrizes Terapêuticas (PCDT) da AME 5q tipos I e II encontra-se aberta, de 21/09 a 11/10/2021. Os interessados em contribuir podem acessar o site do órgão por meio do endereço eletrônico: http://conitec.gov.br/consultas-publicas.
“Esperamos que o poder público atenda as demandas desta comunidade de maneira célere e benéfica para os pacientes com AME. Seguiremos acompanhando as famílias que sofrem com a lentidão para obtenção dos medicamentos”, disse Sâmia.
Conitec
A Conitec é um órgão colegiado federal responsável por assessorar o Ministério da Saúde em suas atribuições quanto à incorporação, exclusão ou alteração pelo SUS de novos medicamentos, produtos e procedimentos, bem como a constituição ou a alteração de protocolo clínico ou de diretriz terapêutica.
Histórico
Em 30 de setembro de 2021, em resposta ao requerimento encaminhado pela deputada Sâmia Bomfim, a Conitec apresentou um histórico acerca dos debates realizados sobre a incorporação e disponibilização de referidos medicamentos no SUS.
Em relação ao medicamento nusinersena (Spinraza®), a Conitec informou que esse foi tema de duas consultas públicas, quais sejam, consulta pública nº12/2019 (realizada entre 19/03/2019 e 28/03/2019) e nº 63/2020 (25/11/2020 a 14/12/2020) e uma audiência pública (realizada em 19/03/2021). Tal processo resultou na incorporação desse medicamento para tratamento da AME 5q tipo II, com diagnóstico até os 18 meses de idade e conforme Protocolo Clínico do Ministério da Saúde, e não incorporação do medicamento para tratamento da AME 5q tipo III, no âmbito do SUS.
Em relação ao medicamento risdiplam (Evrysdi®), a Conitec informou que, desde 07/06/2021, tramita no órgão processo administrativo para incorporação desse medicamento no SUS para tratamento da AME 5q tipos I, II e III. Ademais, informou que tal processo administrativo de incorporação será concluído em prazo não superior a 180 dias, contado da data de protocolado do pedido (07/06), admitida a sua prorrogação por 90 dias corridos, bem como o fato de que a apreciação inicial pelo Plenário da Conitec do risdiplam (Evrysdi®) tem previsão de acontecer na 102ª reunião da Comissão, a ser realizada nos dias 06 e 07 de outubro de 2021. Após a apreciação inicial o tema será submetido à consulta pública para manifestação da sociedade.
Sobre o medicamento onasemnogeno abeparvoveque (Zolgensma®), a Conitec informou que não existe demanda para análise de sua incorporação no SUS, eis que inexiste protocolo de pedido neste sentido nessa comissão, conforme exigência legal (Lei nº 8.080/1990 e Decreto nº 7.646/2011). Caso a demanda venha a ser protocolada na Conitec, o tema será submetido à consulta pública para manifestação da sociedade.
Ademais, conforme informações disponibilizadas pela comissão, todos os medicamentos em questão possuem registro válido na agência reguladora, sendo que: o nusinersena (Spinraza®) foi registrado pela Anvisa em agosto de 2017; o risdiplam (Evrysdi®) foi registrado em outubro de 2020; e a terapia gênica onasemnogeno abeparvoveque (Zolgensma®) foi registrada em agosto de 2020.
O mandato da deputada Sâmia Bomfim continuará trabalhando para garantir pleno acesso aos medicamentos e consequentemente a melhoria na qualidade de vida dos pacientes com AME.
